|

2019年阿尔茨海默病协会国际会议(Alzheimer’s Association International Conference, AAIC)于2019年7月14-18日在美国洛杉矶举行[1]。AAIC是世界上最大和最具影响力的致力于推进痴呆症科学研究的国际会议,它汇集了世界各国一流的基础科学和临床研究人员、临床医师、护理研究团体,一起分享探讨了痴呆及相关疾病的基础科学,痴呆的机制,诊断、治疗等的最新研究发现和解决方案。超过5500名来自世界各地的痴呆症和神经科学研究领域的学者参加了这次盛会。此次会议在洛杉矶会展中心举行,后者与美国国家篮球协会(National Basketball Association,NBA)著名湖人队的斯台普斯中心(Staples Center)毗邻。 阿尔茨海默病协会成立于1980年一个小规模的聚会,发展成为今天的数千来自世界各地的学者交流大会。今年尽管来自中国的壁报约100个,遗憾的是没有口头报告,看到我们的差距,也看到了中国在努力追赶。今年AAIC大会主要进展如下: 一、生活方式改变可以降低痴呆风险 AAIC 2019会议有一项备受关注的研究报道,英国埃克塞特大学(University of Exeter)研究团队,通过对近20万人的研究,得出生活方式改变可以降低痴呆风险,即使有遗传易感基因的个体,通过改变生活方式,也可以显著降低痴呆风险的结论[2]。具体研究对象196383人,从64岁开始随访8年,评估患痴呆的风险。研究发现,有基因携带和不健康生活方式的人群,每1000人18例发展为痴呆,而即使携带易感基因,但生活方式健康的人群,每1000人仅11例发展为痴呆;良好的生活方式可以降低三分之一的痴呆患病率。这项研究还凸显出,高遗传风险或痴呆症家族病史并不能使人不可避免地患上痴呆症。 该研究团队所指减低痴呆的健康生活习惯包括: 不吸烟。 每周中等强度锻炼150min(两个半小时)。 均衡饮食,每天吃三种以上水果和蔬菜,每周至少吃两次鱼,不吃或少吃加工过的肉。 每天喝不超过相当于50度白酒50ml,或啤酒500ml。
在认知正常老年人中,不良(非健康)生活方式和高遗传风险显著增加罹患痴呆的风险。 二、罹患AD机会的性别差异研究进展 1.女性患AD的机会较高。 根据2019年阿尔茨海默病(Alzheimer’s Disease, AD)事实和数据报告,在美国580万AD患者中,约2/3是女性[3]。但是为什么女性更易患AD的原因一直不明确[1]。英国约有65%的痴呆症患者是女性,而痴呆症是英格兰女性死亡的主要原因。AD是痴呆症的最常见原因。虽然有一种解释是痴呆风险随年龄增长而增加,而且女性预期寿命比男性长,但新的研究表明可能有其他原因,包括发现神经元内的神经纤维缠结在女性大脑中更容易传播。最新研究显示女性大脑比男性更容易受到伤害,更易患AD。 本次会议有一个团队报告称,女性大脑比阿尔茨海默氏症患者的新陈代谢高。另一个研究小组发现阿尔茨海默病患病风险受男性和女性不同基因的影响。来自田纳西州纳什维尔的范德比尔特大学医学中心研究小组已经确定AD相关蛋白tau在大脑中传播的性别差异。通过PET扫描301例认知正常人组,包括123名男性和178名女性;161轻度认知障碍组,包括男性101人、女性60人。PET图像显示认知正常组在部分脑区有少量的tau,根据数据合成的图像显示,在女性大脑中tau蛋白更容易扩散。研究表明,tau蛋白像感染一样在大脑中传播,从一个神经元传递到另一个神经元,并将其蛋白质变成异常缠结,导致脑细胞死亡。在这项研究中,研究人员使用来自健康人和轻度认知障碍患者的PET扫描数据来创建tau蛋白如何传播的图表进行分析。结果表明这些影像看起来在女性和男性有所不同,表明tau蛋白可能在女性大脑中传播更快。科学家们开始明白为什么AD对女性的影响大于男性,为什么这种疾病女性患者更多。 2.职业女性不容易罹患痴呆 AAIC 2019发表的一项新研究显示,在年龄在青年期至中年期的工作女性经历较慢的记忆力下降过程,这意味着他们可能罹患痴呆症的风险较低。此研究,针对16-50岁职业女性,无论是否生育孩子,在老年期都比非职业女性维持更好的记忆力。由美国联邦政府资助,美国加利福尼亚州立大学洛杉矶分校和波士顿学院的研究人员追踪生于1935年至1956年间的6,836名美国健康退休女性,对其进行约20年的针的长期观察研究。来自加州大学洛杉矶分校(UCLA)该研究的主要作者伊丽莎白.罗斯.玛雅达(Elizabeth Rose Mayeda)教授指出,其研究结果进一步证实,激励女性参与劳动的政策和计划具有对抗老年痴呆的重要意义。她说:“带薪休假,负担得起儿童保育,同工同酬,所有这些都可以帮助改善女性晚年的健康状况”。 三、女同性恋、男同性恋、双性恋和变性人群体主观认知下降风险增加 美国人的主观认知能力下降率的发生率较高。主观认知能力下降(SCD)被定义为自我报告记忆减退。关于AD和其他痴呆症的变异性因素例如性别,种族,遗传和暴露于环境因素等研究比较少,特别是对AD与女同性恋、男同性恋、双性恋和变性人(lesbian, gay, bisexual, transgender,LGBT)的关联知之甚少。 1.主观认知功能减退(subjective cognitive decline,SCD)与LGBT的关联研究,由加州大学旧金山分校健康与老龄研究所助理教授Jason Flatt博士及其同事实施,他们分析了2015年大型电话调查的风险因素监测系统(BRFSS)的数据。此研究包括美国44,403名年龄在45岁及以上成年人的数据,主要研究内容包括主观认知下降、性取向和性别认同。约3%的参与者(1,253)被确定为LGBT。研究人员发现,超过14%的LBGT有主观认知能力下降,显著高于异性恋人群的10%(p <0.0001)。即使在调整了收入、年龄和种族等因素后,结论仍然如此。作者希望对LGBT人群给予更多关注。 2.首次对LGBT特异性AD和痴呆症进行的干预研究 为了推动对LGBT社区阿尔茨海默病的研究,华盛顿大学健康世代哈特福德卓越中心团队进行了尊严的老龄化痴呆症赋权和行动创新(Innovations in Dementia Empowerment and Action,IDEA)研究[4]。研究人员之前通过对该人群的第一次纵向研究确定患有痴呆症的LGBT老年人(与非LGBT人群相比)有独特危险因素。患有痴呆症的LGBT老年人更可能独自生活(近60%),没有结婚或同居者(65%),没有孩子(72%),没有照顾者(59%)。训练指导老师提供了个性化的锻炼计划,旨在改善其身体机能,独立性和生活质量的行为和应对策略。运动干预是一项低强度的体育锻炼计划,包括为期六周的九次一小时训练,旨在改善身体机能并保持独立性。行为和应对策略包括:处理LGBT特定创伤的方法,身体、隐私的管理,以及社区对LGBT的支持和参与认知障碍的管理服务体系。目前正在进行干预测试研究。将向225对患有痴呆症及其护理人员的LGBT老年人进行测试。 四、睡眠障碍与痴呆的相关研究 1. 服用睡眠药物增加女性患AD的风险 犹他州队列研究结果显示,服用睡眠药物的女性患阿尔茨海默病的风险略高。 犹他州立大学团队分析了犹他州3,656名居民的数据,这些人在基线时没有痴呆症(女性占57.8%),评估了阿尔茨海默病和认知能力下降的风险因素。痴呆症筛查和连续评估四次,每三年一次。研究发现, 与那些不使用睡眠药物的女性相比, 没有睡眠障碍而使用睡眠相关药物的女性患AD的风险更高(HR = 3.916; P=0.0001)。男性的风险为(HR=3.604,P=0.0001)略低与女性。 2.双效食欲素受体拮抗剂(lemborexant)可能改善AD睡眠 卫材公司的研究团队观察研究62名年龄在60~90岁之间的轻度~中度AD和不规则睡眠-觉醒节律关联及lemborexant如何影响几个睡眠相关变量。被试持续书写睡眠日记,并随机选择接受安慰剂或2.5mg,5mg,10mg或15mg剂量的lemborexant治疗。每个受试者携带活动记录仪28天。结果显示,与基线和安慰剂相比,5 mg和15 mg剂量的lemborexant导致相对振幅得分显显著增高和夜间活动水平。 使用5mg和15mg剂量的lemborexant也与睡眠碎片指数较低和总睡眠时间较长相关。此外,患者的认知功能没有明显变化,也未见不良反应事件。 3.多模式个性化疗法有助于改善痴呆患者睡眠 加拿大温哥华不列颠哥伦比亚大学调查96名轻度认知障碍患者(平均年龄71岁; 57%为女性)被试随机分配接受多模式个性化疗法或接受教育指导。患者戴一个活动追踪器,以观察治疗效果。结果研究人员发现,接受时间疗法患者在客观测量的睡眠碎片(P <0.01)和匹兹堡睡眠质量指数(P = .03)方面具有显着的群体时间相互作用。事后分析表明,虽然接受时间疗法的被试在12周内保持相同睡眠分散水平,但接受教育者在12周(P<0.01)和24周时经历睡眠分裂加重(P=0.04)。 阿尔茨海默病协会首席科学官Maria C. Carrillo博士在新闻稿中评论了这三项研究结果的重要性。2019年AAIC报道的新发现非常重要,因为睡眠模式的中断不仅会使痴呆患者整体健康状况更差,还可能使他们的记忆丧失更加严重,思维受到干扰,多达45%的痴呆患者有睡眠问题,AD晚期患者大约40%出现白天睡眠多而夜间易醒的状态,所以控制痴呆患者的睡眠具有重要意义。 五、关于AD治疗的新进展 2019年的AAIC提交了创纪录超过3,400篇会议论文,其中229篇是关于AD临床试验结果或概述。抗淀粉样蛋白药物虽然可能在AD早期阶段有所帮助,即使药物能清除大脑淀粉样斑块,也未证实药物对AD轻度~中度阶段有效。关于预防AD的试验,如A4研究和DIAN试验,可能仍然证明有疗效,期待在未来几年能得到期待的结果。有三项已经引起学者灌注: 1.针对牙龈疾病细菌的实验性药物对AD治疗有效 一项针对AD的新疗法治疗小型试验公布了令人鼓舞的结果。美国开发该疗法的公司Cortexyme说,试验参与者的血液和脑脊液中的某些分子有所改善。 然而,此研究并未报道该疗法可以减轻痴呆严重程度。研究人员在多项研究中发现90%以上的AD患者大脑中有牙龈卟啉单胞菌。在几个不同独立实验室评估的动物模型中,口腔牙龈卟啉单胞菌感染侵入大脑并与AD的大脑变化(包括淀粉样蛋白斑,炎症和海马神经元死亡)相关。这种新方法与几十年来治疗AD的思路不一致。经典假说认为:AD由淀粉样蛋白在大脑中沉积形成斑块,造成神经细胞内发生神经原纤维缠结,引起神经元死亡导致痴呆。但许多减少淀粉样蛋白的疗法未能在试验中阻止疾病进展,所以部分研究人员现在认为这种蛋白质可能不是AD的病因,而只是一个产物[4,5]。此研究团队认为AD可能是由于牙龈卟啉单胞菌(Porphyromonas gingivalis)一种引起牙龈疾病的病菌,以某种方式进入大脑并引发炎症所致。在AD大脑中,次微生物及其毒素的含量略高,已经在小鼠脑证实可引发淀粉样蛋白积聚。因此,Cortexyme公司开发一种名为COR388的口服药物,可以阻止细菌释放毒素。去年,该公司在健康志愿者和9名轻度~中度AD患者进行短暂试验,其中6人每日服用两次胶囊,而其余3名患者服用安慰剂。四周后,对于那些服用该药的患者,测试略有改善。因为目前只是评价药物的安全性,样本太小尚不足以得出药效的结论。 2.给予MCI和AD患者经鼻腔吸入胰岛素,开放延长18个月的研究,结果显示患者的记忆和思维,日常生活能力及AD的生物学标记物均有显著改善。由Wake Forest医学院的老年医学教授Suzanne Craft与Paul Aisen合作领导的2/3阶段临床试验中,招募289名MCI和AD患者。被试每天接受40 IU的安慰剂或胰岛素(Humulin-RU100,Eli Lilly),持续12个月,然后是6个月的开放标签延长观察期。结果包括在第15和18周的AD认知评估量表(ADASCog-12),日常生后能力测试,MCI日常生活量表(ADL-MCI)和AD脑脊液生物标志物(CSF)测定。 3.美国通过生活方式干预保护大脑健康以降低痴呆患病风险的研究 伴随人口老龄化进程,全世界范围内AD和其他痴呆症患者爆炸式增长,迫切需要找到能够在早期阶段阻止或逆转疾病的有效治疗和预防方法。维克森林医学院老年学和老年医学副教授Laura Baker博士是美国POINTER研究的主要研究者之一。研究基于生活方式干预措施的重点是将健康饮食,身体活动和社交活动结合起来,作为保护大脑健康非常有前景的治疗方法。通过生活方式干预保护大脑健康、降低痴呆的患病风险。美国研究(美国指针)比较两种生活方式对未来老年人记忆丧失风险的影响。这是国际上首次进行的此类研究,拟招募2000例60~79岁的志愿者,随机将之分配到两种生活方式干预措施中的一种。一组志愿者进行更多身体和认知活动,以及摄入健康饮食,并定期监测血压和其他健康指标测量。另一组志愿者按照最符合他们自己需求和时间表的生活方式计划。其他干预组的参与者将遵循包括每周健康生活方式活动的特定计划,跟踪随访两年。POINTER提供了一个前所未有的机会,可以测试生活方式改变是否可以保护认知能力下降和减少罹患痴呆的风险。 科学家们使用正电子发射计算机断层显像(PET-CT)淀粉样蛋白扫, 不仅仅是为了诊断AD,还要确定疾病分期。由瑞典隆德大学的Niklas Mattsson和Oskar Hansson领导的研究组报告了一项新的分期计划。 通过741名正常对照,轻度认知功能障碍和AD的纵向数据(至少2次PET检查),包括脑脊液Aβ42以及PET,研究人员确定了淀粉样蛋白积聚的四个阶段。 处于零阶段的人患斑块的风险较低,但处于较高阶段的人可能会在几年内进入下一个更高的阶段,这表明该系统反映了疾病的进展。 此分期系统与横断面成像和神经病理学数据得到的模型明显不同。显示楔前叶和后扣带回的最早出现老年斑沉积,远早期脑的广泛性沉积,可以作为诊断早期AD的特征(下图)[7]。 PET淀粉样蛋白检查阶段与其他生物标志物相关。 与对照组相比,AD脑处于1期或更高的组,则CSF CSFAβ42较低和磷酸化tau较高。在2期或更高阶段,CSF总tau增加,而在第3阶段则出现脑萎缩。同时也发现:处于零阶段的人在平均四年中有15%的风险进入更高阶段,而第一阶段的风险为71%,第二阶段风险为53%。 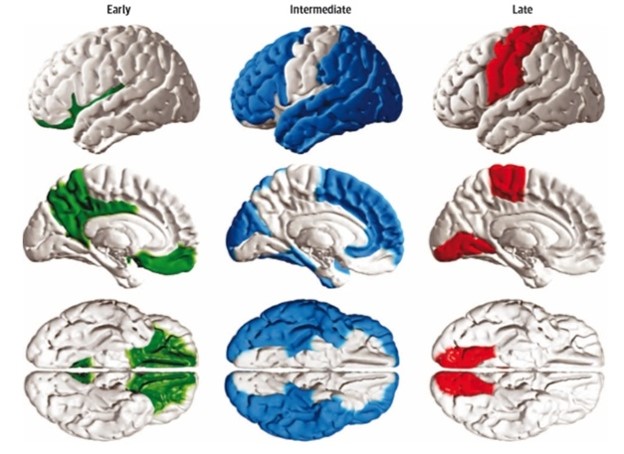
淀粉样蛋白分期: 纵向PET扫描显示早期(绿色),中间(蓝色)和晚期(红色)淀粉样蛋白积聚的区域 七、大会授予的奖励 AAIC 2019授予三项终生成就奖: 1. Henry Wisniewski(AAIC创始人之一)终身成就奖的获得者约翰霍普金斯医院神经病学系认知神经科主任,AD研究中心主任Marilyn S. Albert教授。她的贡献是描述了衰老和早期AD相关的认知变化,及可能早期诊断AD, 生活方式可以延缓衰老与减缓痴呆。 2. Bengt Winblad(AAIC创始人之一)终身成就奖的获得者纽约大学医学中心脑健康中心创始人和主任Mony J. de Leon教授。他是主要贡献是:世界上第一个报告了磁共振成像海马萎缩与AD的关联,第一个研究嗅觉中枢退变与AD的关系研究;第一个报告PET代谢减低与AD密切相关。 3. Khalid Iqbal(AAIC创始人之一)终身成就奖的获得者乌普萨拉大学公共卫生和关怀服务部老年病学Lars Lannfelt教授,他的研究重点是AD脑部的病理变化,他领导了AD候选药物单克隆抗体BAN2401的开发。 
参考文献 AAIC 2019 home page: /aaic. Association of Lifestyle and Genetic Risk With Incidence of Dementia.
Lourida I, Hannon E, Littlejohns TJ, Langa KM, Hyppönen E, Kuzma E, Llewellyn DJ. JAMA. 2019 Jul 14. doi: 10.1001/jama.2019.9879 Alzheimer’s Association. 2018 Alzheimer’s Disease Facts and Figures. Alzheimers Dement 2018;14(3):367-429. Associations of Physical Activity and β-Amyloid With Longitudinal Cognition and Neurodegeneration in Clinically Normal Older Adults.
Rabin JS, Klein H, Kirn DR, Schultz AP, Yang HS, Hampton O, Jiang S, Buckley RF, Viswanathan A, Hedden T, Pruzin J, Yau WW, Guzmán-Vélez E, Quiroz YT, Properzi M, Marshall GA, Rentz DM, Johnson KA, Sperling RA, Chhatwal JP. JAMA Neurol. 2019 Jul 16. doi: 10.1001/jamaneurol.2019.1879. Determining the presence of periodontopathic virulence factors in short-term postmortem Alzheimer's disease brain tissue.
Poole S, Singhrao SK, Kesavalu L, Curtis MA, Crean S. J Alzheimers Dis. 2013;36(4):665-77. doi: 10.3233/JAD-121918. Continuous intracerebroventricular injection of Porphyromonas gingivalis lipopolysaccharide induces systemic organ dysfunction in a mouse model of Alzheimer's disease.
Hayashi K, Hasegawa Y, Takemoto Y, Cao C, Takeya H, Komohara Y, Mukasa A, Kim-Mitsuyama S. Exp Gerontol. 2019 Jun;120:1-5. doi: 10.1016/j.exger.2019.02.007. Staging β-Amyloid Pathology With Amyloid Positron Emission Tomography.
Mattsson N, Palmqvist S, Stomrud E, Vogel J, Hansson O. JAMA Neurol. 2019 Jul 17. doi: 10.1001/jamaneurol.2019.2214
阿尔茨海默病防治协会特邀记者:纪勇,李坤成
|

